Compliance Management: Erfüllen gesetzlicher und behördlicher Vorgaben
Auditierungs- und Dokumentationspflichten rechtssicher und umfassend erfüllen
Eine integrierte Dokumentation sowie (je nach Branche) regulatorisch korrekte Workflows gewährleisten ein zuverlässiges Compliance Management, reduzieren Risiken und sichern einen nachverfolgbaren Produktionsablauf.
Dies ist entscheidend, besonders in branchenspezifischen Bereichen wie Chemie, Pharma und Lebensmittel sowie bei kritischen Infrastrukturen. Bei der Zertifizierung, die international unterschiedlich strikten Regeln unterliegt, lassen sich so ebenfalls Risiken reduzieren. Gerade wenn im Rahmen von Produktions-Audits Haftungsfragen zu klären sind, ist eine klare Datentransparenz unabdingbar.
KUNDENUMFRAGE
Neben der Reduzierung des manuellen Aufwands sind für unsere Anwender:innen die zentralen Vorteile unserer Softwarelösung die Erleichterung der Arbeit sowie die Minimierung von Ausfallzeiten und Produktionsausfällen.*
*Quelle: AUVESY GmbH Kundenumfrage, Befragungszeitraum 2023, 162 Befragte
Funktionen von octoplant Compliance Management

Zuverlässige Compliance
Realisieren Sie Genehmigungsprozesse zur Einhaltung von Branchen-Richtlinien.

Konsistentes Dokumentenmanagement
Erhalten Sie Unterstützung bei der Dokumentation des Systemvalidierungsprozesses für globale Benutzeranforderungen (GURs) und der Verarbeitung von GxP-Dokumenten.

Unsere Kunden berichten aus der Praxis

Dass die Backups nicht nur gespeichert, sondern auch miteinander verglichen werden können, hilft uns bei Audits ganz enorm. Die Software ist gesetzt – alle neuen Projekte werden standardmäßig in der Lösung von AUVESY-MDT angelegt. Es gibt keinen Grund, warum wir je wieder auf das System verzichten sollten.
Unterstützung bei Qualitätssicherung und Dokumentationspflichten
Wenn es um die Einhaltung von technischen Vorgaben, Gesetzen und Richtlinien wie FDA oder GxP geht, wird oftmals eine vielfältige Dokumentation der Produktion und der Herstellungsprozesse gefordert. octoplant unterstützt hinsichtlich Qualitätssicherung, Produktionsdokumentation und Nachweispflichten gegenüber den überwachenden Behörden und Kunden.
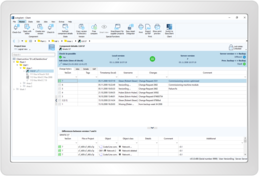
Sie erhalten Antworten auf die typischen Fragestellungen aus der Prozessdokumentation (was, warum, wer, wann, wo) – standardisiert und effizient. Die hohe Datentransparenz und Rückverfolgbarkeit wird durch Audit-Trail-Reports auf Knopfdruck unter Einhaltung der geltenden IT-Gesetze realisiert.
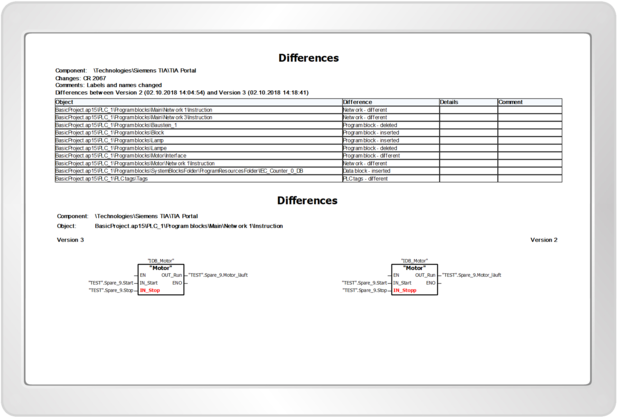
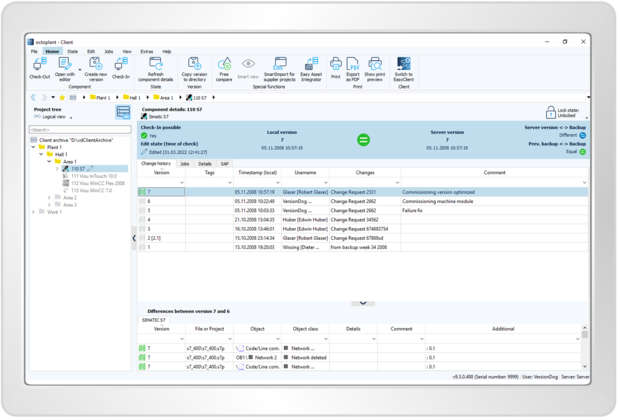
octoplant liefert alle relevanten Informationen im Kontext von Audit-Trail-Prozessen zur Qualitätssicherung und bietet eine durchgängige Änderungshistorie und Dokumentation der Programmänderungen.

Mit der standardisierten Dokumentation werden Sie Ihren Dokumentationspflichten gerecht – und das auf Wunsch unter Einhaltung des Vieraugenprinzips. Dabei bietet die Software Hilfe bei der Einhaltung der ISDS/ISQM-Norm und erlaubt den speziellen Zuschnitt auf FDA- und GxP-Anforderungen.
Häufig gestellte Fragen
Viele Anforderungen des IT-Grundschutzes für Industrial Control Systems (ICS) können mit octoplant erfüllt werden. Insbesondere Prävention, Detektion sowie Reaktion in Bezug auf ICS sind Key Values von octoplant.
octoplant unterstützt durch elektronische Signaturen die Anforderungen aus FDA 21 CFR Part 11 und der GMP.
Ist die Option für GxP-Kunden aktiviert, so ist es – während eines Versionierungs- oder Check-in-Prozesses – notwendig, dass eine weitere Person diesen Prozess mit seinen Credentials freigibt bzw. bestätigt.
Ja, mit Hilfe der Kommentarfunktionen beim Vergleich lassen sich Änderungen an den Programmen dokumentieren. Hierbei besteht die Möglichkeit, die Änderungen global oder jede einzelne Anpassung separat zu dokumentieren.